Личный кабинет

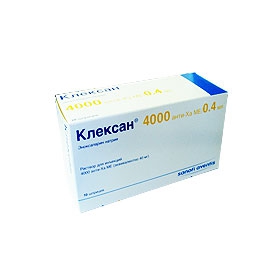
КЛЕКСАН 300 раствор для ин. 10000 анти-Ха МЕ/1мл флакон многодозовый 3 мл
rx
Код товара: 134319
Производитель: Санофи-Авентис (Украина)
970,00 грн
в наличии
Цена и наличие актуальны на: 24.02.2026
- Настоятельно просим до поездки в аптеку уточнять наличие, цену и срок годности в интересующей Вас аптеке.
- Внешний вид товара в аптеке может отличаться от товара на сайте.
- Информация о производителе на сайте может отличаться от реальной.
- Информация предоставлена с ознакомительной целью и не должна быть использована как руководство к самолечению.
- Самолечение может быть опасным для Вашего здоровья! Перед применением, проконсультируйтесь с врачом!
ІНСТРУКЦІЯ
для медичного застосування лікарського засобу
КЛЕКСАН 300
CLEXANE 300
Склад:
діюча речовина: еноксапарин;
1 мл розчину містить еноксапарину натрію 10 000 анти-Ха МО − еквівалентно еноксапарину натрію 100 мг;
допоміжні речовини: спирт бензиловий, вода для ін’єкцій.
Лікарська форма. Розчин для ін`єкцій.
Основні фізико-хімічні властивості: безбарвний або блідо-жовтого кольору, прозорий розчин.
Фармакотерапевтична група. Антитромботичні засоби. Група гепарину.
Код АТХ В01А В05.
Фармакологічні властивості.
Фармакодинаміка. Еноксапарин є низькомолекулярним гепарином, у якого антитромботична та антикоагулянтна активність стандартного гепарину не пов’язані між собою. Йому властиве більш високе співвідношення анти-Ха до анти-ІІа (антитромбінової) активності. Для еноксапарину співвідношення цих двох видів активності становить 3,6.
Як і для стандартного гепарину, анти-Ха та анти-ІІа активність еноксапарину обумовлена його впливом на антитромбін.
У профілактичних дозах препарат не виявляє значущого впливу на рівень активованого часткового тромбопластинового часу (аЧТЧ).
У лікувальних дозах при максимальній активності препарату аЧТЧ може подовжуватися у 1,5–2,2 раза порівняно з контрольним часом. Ця пролонгація відображає залишкову антитромбінову активність.
Лікування гострого інфаркту міокарда з підйомом сегмента ST у комбінації з тромболітичним засобом у хворих, для яких можливе подальше проведення черезшкірного коронарного втручання або ні. У ході великого багатоцентрового клінічного дослідження після застосування фібринолітичної терапії 20479 хворих з гострим інфарктом міокарда з підняттям сегмента ST, були рандомізовано розподілені на групи для отримання або еноксапарину у вигляді болюсної внутрішньовенної ін’єкції 3000 анти-Ха МО з подальшою невідкладною підшкірною дозою 100 анти-Ха МО/кг, а потім − підшкірних ін’єкцій по 100 анти-Ха МО/кг кожні 12 годин, або для введення внутрішньовенного нефракціонованого гепарину у вигляді болюсної ін’єкції 60 МО/кг (максимум 4000 МО/кг) з подальшою постійною інфузією в дозі, що була скоригована за аЧТЧ. Підшкірні ін’єкції еноксапарину вводили до виписки зі стаціонару або не більше 8 днів (у 75 % − не менше 6 днів). Половині хворих, які отримували гепарин, препарат вводили не менше 48 годин (у 89,5 % випадків ≥ 36 − годин). Усі хворі також отримували ацетилсаліцилову кислоту протягом не менше 30 днів. Дозу еноксапарину для хворих віком ≥ 75 років скорегували: 75 МО/кг у вигляді підшкірної ін’єкції кожні 12 годин без початкової болюсної внутрішньовенної ін’єкції.
У ході дослідження 4716 (23 %) хворим зробили коронарну ангіопластику на тлі антитромботичної терапії із застосуванням замаскованих досліджуваних препаратів. Хворі не отримували додаткових доз, якщо з моменту останньої підшкірної ін’єкції еноксапарину до надування балона пройшло менше 8 годин, або ж отримували болюсну внутрішньовенну ін’єкцію еноксапарину, 30 анти-Ха МО/кг, якщо з моменту останньої підшкірної ін’єкції еноксапарину до надування балона пройшло більше 8 годин.
Еноксапарин дав змогу значно знизити частоту первинних кінцевих подій (комбінована кінцева, що включає в себе рецидив інфаркту міокарда та смертність з будь-якої причини, які спостерігалися протягом 30-денного періоду після зарахування до дослідження: 9,9 % у групі еноксапарину порівняно з 12,0 % у групі нефракціонованого гепарину (зниження відносного ризику – 17 % (р<0,001)). Частота рецидиву інфаркту міокарда була значно нижча у групі еноксапарину (3,4 % порівняно з 5 %, р<0,001, зниження відносного ризику – 31 %). Смертність була нижча в групі еноксапарину без статистично значущої різниці між групами (6,9 % порівняно з 7,5 %, р=0,11).
Перевага еноксапарину за первинною кінцевою точкою була послідовною незалежно від підгрупи за віком, статтю, локалізацією ІМ, наявністю цукрового діабету або ІМ в анамнезі, типу призначеного тромболітика та інтервалу часу між появою перших клінічних ознак і початком лікування мається на увазі між появою ознак захворювання і початком лікування, а не проміжок часу між появою проявів хвороби .
Було продемонстровано статистично значущі переваги еноксапарину порівняно з нефракціонованим гепарином за первинною кінцевою точкою ефективності як у пацієнтів, яким виконували коронарну ангіопластику протягом 30 днів після включення у дослідження (10,8 % порівняно з 13,9 %, відносне зниження ризику на 23 %), так і у пацієнтів, яким не виконували коронарну ангіопластику (9,7 % порівняно з 11,4 %, відносне зниження ризику на 15 %).
Частота виникнення серйозних геморагічних явищ протягом 30 днів була статистично значущо (p<0,0001) вищою в групі застосування еноксапарину (2,1 %) порівняно з групою застосування гепарину (1,4 %). В групі застосування еноксапарину була вища частота шлунково-кишкових кровотеч (0,5 %) порівняно з групою застосування гепарину (0,1 %), тоді як частота внутрішньочерепних крововиливів в обох групах була подібною (0,8 % на фоні прийому еноксапарину порівняно з 0,7 % на тлі прийому гепарину).
Аналіз комбінованої кінцевої точки, за якою оцінювалася загальна клінічна перевага, продемонстрував статистично значущі переваги (p<0,0001) еноксапарину порівняно з нефракціонованим гепарином: відносне зниження ризику становило 14 % на користь еноксапарину (11 % порівняно з 12,8 %) за комбінованою кінцевою точкою, яка включала випадки смерті, випадки рецидиву ІМ і випадки серйозних геморагічних явищ (критерії TIMI) протягом 30 днів, і 17 % (10,1 % порівняно з 12,2 %) за комбінованою кінцевою точкою, яка включала випадки смерті, рецидиву ІМ і внутрішньочерепних крововиливів протягом 30 днів.
Через 12 місяців спостерігалося зниження відносного ризику на користь еноксапарину, що становило 8% (95% ДІ: 2-14%) для комбінованої кінцевої точки: повторне виникнення інфаркту міокарда та смерть з будь-якої з причин.
Фармакокінетика. Фармакокінетичні параметри еноксапарину оцінювалися за зміною анти-Ха та анти-ІІа активності у плазмі крові з часом (за допомогою валідованих амідолітичних методів) при застосуванні препарату у рекомендованих дозах після одноразового та повторного підшкірного введення та після одноразової внутрішньовенної ін’єкції.
Біодоступність. При підшкірному введенні еноксапарин всмоктується швидко та майже повністю (майже на 100 %). Максимальна активність у плазмі крові спостерігається через 3-4 години після введення. Ця максимальна активність (виражена у МО анти-Ха) становить 0,18 ± 0,04 (після введення 2000 МО анти-Ха), 0,43 ± 0,11 (після введення 4000 МО анти-Ха) при профілактичному лікуванні та 1,01 ± 0,14 (після введення 10 000 МО анти-Ха) при лікувальній терапії.
Внутрішньовенна болюсна ін’єкція 3000 МО анти-Ха з подальшим підшкірним введенням 100 МО анти-Ха/кг маси тіла кожні 12 годин призводить до утворення першого піка рівнів анти-Ха активності величиною 1,16 МО/мл (n=16) та середньої експозиції, що відповідає 88 % рівноважного рівня. Рівноважний стан досягається на другий день терапії.
У рекомендованому діапазоні доз фармакокінетика еноксапарину є лінійною. Інтраперсональна та міжперсональна варіабельність низька. Після повторного підшкірного введення препарату здоровим добровольцям у дозі 4000 анти-Ха МО один раз на добу рівноважний стан був досягнутий на другий день, при цьому середня активність еноксапарину була приблизно на 15 % вища, ніж та, що спостерігалася при однократному введенні дози препарату. Рівні активності еноксапарину у рівноважному стані добре прогнозуються фармакокінетикою препарату при одноразовому введенні дози препарату. Після багаторазового підшкірного введення препарату у дозі 100 анти-Ха МО/кг маси тіла двічі на добу рівноважний стан було досягнуто у період між днями 3 та 4, при цьому середня концентрація у плазмі була на 65 % вища, ніж та, що спостерігалася при однократному введенні дози препарату, а максимальна та мінімальна анти-Ха активність становила 1,2 та 0,52 анти-Ха МО/мл відповідно. З огляду на фармакокінетику еноксапарину натрію ця різниця у характеристиках рівноважного стану є очікуваною та знаходиться у терапевтичних межах.
Анти-ІІа активність у плазмі крові після підшкірного введення майже у 10 разів нижча, ніж анти-Ха активність. Середня максимальна анти-ІІа активність спостерігається приблизно через 3-4 години після підшкірної ін’єкції, досягаючи 0,13 МО анти-ІІа/мл після повторного введення препарату у дозі 100 МО анти-Ха/кг двічі на добу.
При одночасному застосуванні еноксапарину і тромболітичного засобу фармакокінетичної взаємодії виявлено не було.
Розподіл. Об’єм розподілу анти-Ха активності еноксапарину натрію становить приблизно 5 літрів і майже відповідає об’єму циркулюючої крові.
Метаболізм. Метаболізм еноксапарину відбувається переважно у печінці (шляхом десульфатизації та деполімеризації).
Виведення. Після підшкірної ін’єкції період напіввиведення анти-Ха активності у низькомолекулярних гепаринів (НМГ) є більш тривалим порівняно з цим показником для нефракціонованих гепаринів.
Виведення еноксапарину має монофазний характер, при цьому період напіввиведення становить близько 4 годин після одноразового підшкірного введення та майже 7 годин після повторного підшкірного введення.
При застосуванні НМГ зниження в плазмі крові анти-IIа активності відбувається швидше, ніж анти-Ха активності.
Еноксапарин та його метаболіти виводяться з сечею (ненасичуваний механізм), а також з жовчю.
Нирковий кліренс залишків з анти-Ха активністю охоплює приблизно 10 % введеної дози, а загальна ниркова екскреція активних та неактивних сполук – 40 % дози.
Підгрупи підвищеного ризику.
Пацієнти літнього віку. Оскільки у цій популяції спостерігається фізіологічне зниження функції нирок, то елімінація є більш повільною. Це не впливає на дозування або схему введення препарату при проведенні профілактичного лікування, поки ниркова функція у таких пацієнтів залишається в прийнятних межах, тобто якщо вона знижується лише у невеликій мірі.
У пацієнтів літнього віку (понад 75 років), дуже важливо систематично оцінювати функцію нирок за допомогою формули Кокрофта перед початком лікування НМГ (див. розділ «Особливості застосування»).
Пацієнти з легкою та помірною нирковою недостатністю (кліренс креатиніну > 30 мл/хв). В окремих випадках може бути корисним здійснювати моніторинг анти-Ха активності для запобігання передозуванню, коли еноксапарин застосовується для лікувальної терапії (див. розділ «Особливості застосування»).
Гемодіаліз. Низькомолекулярний гепарин вводиться у артеріальну частину гемодіалізного контуру у дозах, достатніх для запобігання зсіданню крові у контурі. Фармакокінетичні параметри препарату при цьому загалом залишаються незмінними, за винятком випадків передозування або потрапляння препарату у загальне кров’яне русло, що призводить до високих рівнів анти-Ха активності у зв’язку із термінальною нирковою недостатністю.
Клінічні характеристики.
Показання.
Профілактика венозної тромбоемболії при хірургічних втручаннях помірного або високого ризику.
Попередження згортання крові в екстракорпоральній системі кровообігу під час процедури гемодіалізу (зазвичай при її тривалості 4 години або менше).
Лікування діагностованого тромбозу глибоких вен, що супроводжується легеневою тромбоемболією або без неї та не має тяжких клінічних симптомів, за винятком легеневої тромбоемболії, яка вимагає лікування тромболітичним засобом або хірургічного втручання.
Лікування нестабільної стенокардії та гострого інфаркту міокарда без зубця Q, у комбінації з ацетилсаліциловою кислотою.
Лікування гострого інфаркту міокарда з підйомом сегмента ST, у комбінації з тромболітичним засобом у хворих для яких можливе подальше застосування коронарної ангіопластики, а також без неї.
Протипоказання.
Незалежно від дози (лікувальної або профілактичної) Клексан® 300 не можна застосовувати у таких випадках:
- підвищена чутливість до еноксапарину, гепарину або його похідних, у тому числі інших низькомолекулярних гепаринів (НМГ), підвищена чутливість до допоміжних речовин (бензиловий спирт);
- наявність в анамнезі тяжкої гепариніндукованої тромбоцитопенії (ГІТ) типу ІІ, спричиненої нефракціонованим або низькомолекулярним гепарином (див. розділ «Особливості застосування»);
- кровотеча або схильність до кровотечі, що пов’язана з порушенням гемостазу (можливим винятком з цього протипоказання може бути дисемінована внутрішньосудинна коагуляція, якщо вона не пов’язана з лікуванням гепарином (див. розділ «Особливості застосування»));
- органічні ураження органів зі схильністю до кровотечі;
- активна кровотеча клінічно значущого ступеня;
- дитячий вік до 3 років, через вміст бензилового спирту (15 мг/мл). Таким хворим слід призначати нефракціонований гепарин. У недоношених немовлят під час введення лікарських засобів, що містять бензиловий спирт, спостерігалося таке порушення дихання, як синдром утрудненого дихання (метаболічний ацидоз, неврологічні розлади, паузи в диханні та ін.) (див. розділ «Діти»).
Клексан® 300 не можна застосовувати у лікувальних дозах в таких випадках:
- внутрішньомозковий крововилив;
- активна виразка шлунка або дванадцятипалої кишки;
- через відсутність відповідних даних, при тяжкій нирковій недостатності (кліренс креатиніну 30 мл/хв за формулою Кокрофта), крім окремих випадків у хворих, які перебувають на діалізі. Хворим з тяжкою нирковою недостатністю слід призначати нефракціонований гепарин.
Для розрахунку за формулою Кокрофта потрібно знати масу тіла хворого за останнім визначенням (див. розділ «Особливості застосування»).
Спінальну або епідуральну анестезію не слід ні в якому разі застосовувати хворим, які знаходяться на лікуванні НМГ. Хворим, які отримують гепарин для лікування, а не для профілактики, місцево-регіонарна анестезія при планових хірургічних втручаннях.
Не рекомендується застосовувати цей препарат у лікувальних дозах у таких випадках:
- гострий обширний ішемічний інсульт з або без втрати свідомості. Якщо інсульт спричинено емболією, у перші 72 години після випадку еноксапарин застосовувати не можна. Ефективність лікувальних доз НМГ залежно від причини, ступеня та тяжкості клінічних проявів ішемічного інсульту дотепер не визначено;
- гострий інфекційний ендокардит (крім деяких ембологених серцевих ускладнень);
- ниркова недостатність легкого або помірного ступеня (кліренс креатиніну 30-60 мл/хв).
Крім того, лікувальні дози препарату Клексан® загалом не рекомендується призначати хворим, незалежно від їх віку, у комбінації з такими препаратами (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»):
1. Ацетилсаліцилова кислота в знеболювальних, жарознижувальних та протизапальних дозах.
2. Нестероїдні протизапальні лікарські засоби (НПЗЛЗ) (системне застосування).
3. Декстран 40 (парентеральне застосування).
Звичайно Клексан® у профілактичних дозах не рекомендується у таких випадках:
- хворі з тяжкою нирковою недостатністю (кліренс креатиніну 30 мл/хв за формулою Кокрофта, див. розділ «Особливості застосування»);
- у перші 24 години після внутрішньомозкового крововиливу.
Крім того, Клексан® у профілактичних дозах не рекомендується призначати хворим віком понад 65 років у комбінації з такими лікарськими засобами (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»):
1. Ацетилсаліцилова кислота у знеболювальних, жарознижувальних та протизапальних дозах.
2. НПЗЛЗ (системне застосування).
3. Декстран 40 (парентеральне застосування).
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Певні лікарські засоби або терапевтичні класи можуть сприяти розвитку гіперкаліємії: солі калію, калійзберігаючі діуретики, інгібітори ангіотензинперетворюючого ферменту, інгібітори ангіотензину ІІ, нестероїдні протизапальні засоби, гепарини (низькомолекулярні або нефракціоновані гепарини), циклоспорин та такролімус, триметоприм.
Виникнення гіперкаліємії може залежати від пов’язаних з нею факторів ризику. Ризик її виникнення зростає, якщо вищевказані лікарські засоби застосовуються одночасно.
Хворі віком до 65 років, які отримують лікувальні дози НМГ, та хворі літнього віку (понад 65 років), незалежно від дози НМГ.
Небажані комбінації.
З ацетилсаліциловою кислотою у знеболювальних, жарознижувальних та протизапальних дозах (за екстраполяцією і іншими саліцилатами): підвищений ризик виникнення кровотечі (пригнічення саліцилатами функції тромбоцитів та ураження слизової оболонки травного тракту). Слід застосовувати жарознижувальні, знеболювальні засоби, що не належать до саліцилатів (наприклад парацетамол).
З НПЗЛЗ, включаючи кеторолак (системне застосування): підвищений ризик виникнення кровотечі (пригнічення НПЗЛЗ функції тромбоцитів та ураження слизової оболонки шлунково-кишкового тракту). Якщо неможливо уникнути одночасного застосування, слід проводити ретельне клінічне спостереження.
З декстраном 40 (парентеральне застосування): підвищений ризик виникнення кровотечі (пригнічення декстраном 40 функції тромбоцитів).
Комбінації, що потребують запобіжних заходів.
З пероральними антикоагулянтами: посилення антикоагуляційного ефекту. При заміні гепарину пероральним антикоагулянтом слід посилити клінічний нагляд.
Комбінації, що потребують обережного застосування.
З інгібіторами агрегації тромбоцитів (окрім ацетилсаліцилової кислоти у знеболювальних, жарознижувальних та протизапальних дозах): абсиксимаб, ацетилсаліцилова кислота в антиагрегантних дозах при кардіологічних та неврологічних показаннях, берапрост, клопідогрель, ептифібатид, ілопрост, тиклопідин, тирофібан: підвищений ризик виникнення кровотечі.
Хворі віком до 65 років, які отримують профілактичні дози НМГ.
Комбінації, що потребують обережного застосування.
Комбіноване застосування лікарських засобів, що впливають на різні фази гемостазу, підвищує ризик виникнення кровотечі. Отже, незалежно від віку хворого слід проводити постійний моніторинг клінічної картини та за необхідності виконувати лабораторні аналізи, коли призначаються профілактичні дози НМГ одночасно з пероральними антикоагулянтами, інгібіторами агрегації тромбоцитів (абсиксимаб, НПЗЛЗ, ацетилсаліцилова кислота у будь-якій дозі, клопідогрель, системні глюкокортикостероїди, ептифібатид, ілопрост, тиклопідин, тирофібан) та тромболітичними засобами.
Особливості застосування.
Хоча концентрації різних низькомолекулярних гепаринів визначаються в міжнародних одиницях (МО) анти-Ха активності, їх ефективність визначається не тільки за їх анти-Ха активністю. Небезпечно заміняти один режим дозування НМГ на інший, оскільки кожний режим було обґрунтовано специфічними клінічними дослідженнями. Отже, при застосуванні кожного препарату слід дотримуватися особливої обережності та виконувати спеціальні інструкції для застосування.
Клексан® 300 містить 15 мг/мл спирту бензилового, що може спричинити токсичні та анафілактичні реакції у дітей віком до 3 років.
Попередження.
Ризик виникнення кровотечі. Необхідно дотримуватись рекомендованих режимів дозування (дози та тривалість лікування). Невиконання цих рекомендацій може спричинити розвиток кровотечі, зокрема у хворих з груп підвищеного ризику (хворі літнього віку, з нирковою недостатністю та ін.).
Випадки тяжких кровотеч були зареєстровані у хворих літнього віку, зокрема через зниження функції нирок, що виникає з віком; у хворих з нирковою недостатністю; у хворих з масою тіла нижче 40 кг; при лікуванні, тривалість якого перевищила рекомендовану середню тривалість 10 днів; при недотриманні терапевтичних рекомендацій (зокрема тих, що стосуються тривалості лікування та корегування дози відповідно до маси тіла при лікуванні); при одночасному застосуванні з препаратами, які підвищують ризик розвитку кровотечі (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
У будь-якому випадку хворі літнього віку та/або хворі з нирковою недостатністю, а також хворі, лікування яких триває більше 10 днів, повинні знаходитись під спеціальним спостереженням.
В окремих випадках кількісне визначення анти-Ха активності може бути корисним для виявлення накопичування препарату (див. розділ «Особливості застосування»).
Ризик гепариніндукованої тромбоцитопенії (ГІТ). При розвитку таких тромболітичних ускладнень як: у хворого, який отримує НМГ (у лікувальних або профілактичних дозах):
- загострення тромбозу, лікування якого проводиться;
- флебіт;
- емболія легенів;
- гостра ішемія нижніх кінцівок;
- інфаркт міокарда або інсульт;
завжди слід припускати можливість розвитку ГІТ та терміново визначати рівень тромбоцитів (див. розділ «Особливості застосування»).
Механічні протези клапанів серця. Застосування еноксапарину для профілактики тромбоемболічних ускладнень у пацієнтів з механічними протезами клапанів серця окремо не вивчалось. Однак декілька окремих випадків тромбозу було зареєстровано у хворих з механічними протезами клапанів серця, які отримували еноксапарин для профілактики тромбоемболічних ускладнень.
Вагітність. У ході клінічного дослідження з участю вагітних жінок з механічними протезами клапанів серця, які отримували 100 анти-Ха МО еноксапарину/кг два рази на добу для зменшення ризику тромбоемболічних ускладнень, у двох з восьми жінок розвився тромбоз, що спричинив обструкцію клапана, яка призвела до загибелі матері та плода. Більше того, окремі випадки тромбозу у вагітних жінок з механічними протезами клапанів серця, які отримували еноксапарин для профілактики тромбоемболічних ускладнень, було зареєстровано під час післяреєстраційного нагляду за препаратом. Отже, у таких хворих ризик тромбоемболічних ускладнень підвищений.
Застереження при застосуванні.
Геморагічні явища. Як і у разі застосування інших антикоагулянтів, можливе виникнення кровотечі (див. розділ «Побічні реакції»). При розвитку кровотечі слід дослідити її причину та призначити відповідне лікування.
Функція нирок. Перш ніж почати лікування низькомолекулярним гепарином, слід оцінити стан ниркової функції, зокрема у хворих віком від 75 років, шляхом визначення кліренсу креатиніну за останньою масою тіла та формулою Кокрофта:
- для хворих чоловічої статі: кліренс креатиніну = (140-вік) х маса тіла/(0,814 х креатинін у сироватці), де вік виражено в роках, маса тіла – в кілограмах, а креатинін в сироватці – в мікромоль/л;
- для жінок цю формулу корегують шляхом множення результату на 0,85;
- якщо сироватковий креатинін виражено в мг/мл, показник слід помножити на коефіцієнт 8,8.
Застосування лікувальних доз НМГ хворим з діагностованою тяжкою нирковою недостатністю (кліренс креатиніну 30 мл/хв) протипоказано.
Лабораторні показники.
Контроль рівня тромбоцитів і ризик гепариніндукованої тромбоцитопенії (наприклад, ГІТ ІІ типу). НМГ можуть індукувати розвиток ГІТ II типу – серйозної імуноопосередкованої тромбоцитопенії, яка може спричинити артеріальні або венозні тромбоемболічні події, що можуть бути небезпечними для життя або погіршувати функціональний прогноз для пацієнта (див. розділ «Побічні реакції»). Для своєчасного виявлення ГІТ за пацієнтами необхідно здійснювати контроль у такому порядку:
Пацієнти, що перенесли оперативне втручання або нещодавно отримали травму (протягом 3 місяців). Незалежно від того, призначається препарат для лікувальної або профілактичної терапії, в усіх пацієнтів необхідне систематичне виконання лабораторних досліджень, оскільки частота ГІТ становить > 0,1 % або навіть > 1 % у хірургії та травматології. Ці дослідження мають включати визначення вмісту тромбоцитів:
- перед призначенням НМГ або не пізніше ніж через 24 години після початку терапії препаратом;
- у подальшому двічі на тиждень протягом одного місяця (період максимального ризику);
- у подальшому, якщо лікування продовжується, один раз на тиждень до відміни препарату.
Пацієнти з іншими станами, відмінними від оперативного втручання або нещодавньої травми (протягом 3 місяців). Незалежно від того, призначається препарат для лікувальної або профілактичної терапії, необхідне систематичне виконання лабораторних досліджень згідно із тими ж принципами, що застосовуються в хірургії і травматології (див. вище), у пацієнтів:
- які раніше отримували нефракціонований гепарин (НФГ) або НМГ в останні 6 місяців, враховуючи, що частота ГІТ становить > 0,1% або навіть > 1 %;
- які мають значущі супутні захворювання, враховуючи потенційну тяжкість ГІТ у таких пацієнтів.
У інших випадках, беручи до уваги більш низьку частоту розвитку ГІТ (< 0,1 %), контроль вмісту тромбоцитів може бути обмежений такими заходами:
- контроль вмісту тромбоцитів на початку лікування або не пізніше ніж через 24 години після початку лікування;
- контроль вмісту тромбоцитів за наявності клінічної симптоматики, що може вказувати на ГІТ (будь-який новий епізод артеріальної та/або венозної тромбоемболії, будь-яке болісне ураження шкіри в місці ін’єкції, будь-які алергічні або анафілактичні симптоми на тлі лікування). Пацієнта необхідно поінформувати про можливість виникнення таких симптомів і про потребу повідомлення про них лікарю.
Слід припустити виникнення ГІТ, якщо вміст тромбоцитів нижче 150 000/мм3 (або 150 Гіга/л) та/або якщо спостерігається відносне зменшення кількості тромбоцитів на 30-50 % порівняно з попереднім визначенням вмісту тромбоцитів. ГІТ розвивається переважно через 5-21 день після початку лікування гепарином (з максимальною частотою розвитку через приблизно 10 днів). Однак у пацієнтів із ГІТ в анамнезі це ускладнення може виникнути значно раніше, і повідомлялося про окремі випадки його розвитку після 21 дня лікування. У зв’язку з цим слід докладати систематичних зусиль для виявлення пацієнтів з таким анамнезом шляхом детального опитування перед початком лікування. В усіх випадках виникнення ГІТ є невідкладним станом і вимагає консультації зі спеціалістом. Будь-яке значне зменшення вмісту тромбоцитів (на 30-50 % порівняно із вихідними показниками) є попереджувальним сигналом, навіть якщо показники не досягли критичного рівня. Якщо спостерігається зниження вмісту тромбоцитів, то в усіх випадках необхідно вжиті таких заходів:
1. Негайно визначити вміст тромбоцитів для підтвердження отриманих результатів.
2. Відмінити терапію гепарином, якщо цей аналіз підтверджує зниження вмісту тромбоцитів або навіть вказує на його посилення та якщо іншої очевидної причини цього не виявлено. Для проведення in vitro тесту на агрегацію тромбоцитів та імунологічного дослідження зразок необхідно помістити у пробірку з цитратним розчином. Однак за таких умов негайні заходи, яких необхідно вжити, не повинні ґрунтуватися на результатах in vitro тесту на агрегацію тромбоцитів або імунологічного дослідження, оскільки існує лише декілька спеціалізованих лабораторій, які можуть проводити такі тести у звичному порядку, а їх результати можна отримати в найкращому випадку лише через декілька годин. Проте такі дослідження є необхідними, оскільки можуть допомогти діагностувати це ускладнення, оскільки ризик виникнення тромбозу при продовженні лікування гепарином у таких випадках є дуже високим.
3. Проводити профілактику або лікування тромботичних ускладнень, пов’язаних з ГІТ. Якщо продовження антикоагулянтної терапії є дуже важливим, гепарин слід замінити антитромботичним засобом, що належить до іншої групи препаратів, наприклад натрію данапароїдом або лепірудином, та який призначають у лікувальних чи профілактичних дозах індивідуально для кожного пацієнта. Заміна пероральними антикоагулянтами може проводитися тільки після того, як вміст тромбоцитів повернеться до норми, оскільки існує ризик загострення тромбозу при застосуванні пероральних антикоагулянтів.
Заміна гепарину пероральними антикоагулянтами. Слід посилити клінічний нагляд та підвищити частоту виконання лабораторних аналізів (протромбіновий час, що виражений як міжнародне нормалізоване співвідношення (МНС)) для контролю за дією пероральних антикоагулянтів.
У зв’язку з існуванням періоду, який передує розвитку максимального ефекту перорального антикоагулянту, лікування гепарином потрібно проводити постійною дозою протягом часу, достатнього для підтримування МНС у бажаному для цього терапевтичного показання інтервалі між двома послідовними аналізами.
Контролювання анти-Ха активності. Оскільки більшість клінічних досліджень, які продемонстрували ефективність НМГ, були проведені із застосуванням дози, розрахованої за масою тіла без спеціального лабораторного контролю, необхідність у лабораторних аналізах для визначення ефективності лікування НМГ не встановлена. Однак при певних клінічних станах, які часто супроводжуються ризиком передозування, відстеження анти-Ха активності може бути корисним для забезпечення контролю над ризиком виникнення кровотечі.
У зв’язку з дозами, що призначаються, такі випадки здебільшого стосуються лікувальних показань до застосування НМГ у хворих:
- з легкою та помірною нирковою недостатністю (кліренс креатиніну 30-60 мл/хв за формулою Кокрофта). Оскільки на відміну від стандартного нефракціонованого гепарину НМГ виводиться переважно нирками, будь-яка ниркова недостатність може спричинити відносне передозування. Тяжка ниркова недостатність є протипоказанням до застосування НМГ у лікувальних дозах (див. розділ «Протипоказання»);
- з надзвичайно високою або низькою масою тіла (худорлявість або навіть кахексія, ожиріння);
- з кровотечею невизначеної етіології.
Навпаки, проведення лабораторного моніторингу не рекомендується у разі застосування профілактичних доз, якщо лікування НМГ проводиться відповідно до терапевтичних рекомендацій (зокрема тривалість лікування), а також під час гемодіалізу.
Для виявлення можливого накопичування гепарину після повторного введення рекомендується у разі необхідності брати кров на аналіз на піку активності (згідно з наявними даними, тобто через 4 години після третьої ін’єкції при підшкірному введенні препарату 2 рази на добу).
Повторні аналізи анти-Ха активності для визначення рівня гепарину в крові повинні призначатися кожні 2-3 дні в індивідуальному порядку залежно від результатів попереднього аналізу; також може бути необхідним коригування дози НМГ.
Анти-Ха активність, виявлена при спостереженні, змінюється залежно від окремого НМГ та окремого режиму дозування.
До відома: виходячи з наявних даних, середній показник (± стандартне відхилення), який спостерігався через 4 години після 7 ін’єкції еноксапарину, що вводився у дозі 100 анти-Ха МО/кг/ін’єкцію 2 рази на добу, становить 1,20±0,17 анти-Ха МО/мл.
Цей середній показник спостерігався під час клінічних досліджень щодо кількісного визначення анти-Ха активності хромогенним (амідолітичним) методом.
Активований частковий тромбопластиновий час (аЧТЧ). Деякі НМГ помірно підвищують аЧТЧ. Оскільки клінічне значення цього показника не доведено, немає необхідності використовувати цей тест для моніторингу лікування.
Спінальна/епідуральна анестезія у хворих, які отримують профілактичне лікування НМГ.
Як і інші антикоагулянти, НМГ при застосуванні під час спінальної/епідуральної анестезії рідко можуть призводити до виникнення гематоми спинного мозку та довготривалого або постійного паралічу.
Ризик спінальної гематоми є вищим у разі епідуральної анестезії із застосуванням катетера порівняно зі спінальною анестезією.
Ризик цих рідкісних явищ може зростати при тривалому післяопераційному використанні епідуральних катетерів або у пацієнтів, які у минулому перенесли хірургічні втручання на хребті або мали деформацію хребта (наприклад анкілозуючий спондилоартрит).
Якщо лікар приймає рішення про призначення антикоагулянтів на фоні проведення епідуральної/спінальної анестезії, необхідна надзвичайна пильність та постійний контроль для виявлення будь-яких симптомів неврологічних порушень, таких як біль по серединній лінії спини, порушення чутливих та рухових функцій (оніміння або слабкість нижніх кінцівок), дисфункція кишечнику та/або сечового міхура. Пацієнтів необхідно попередити про необхідність негайно повідомляти своєму лікарю про виникнення у них будь-яких з вищеназваних симптомів. Якщо підозрюється спінальна гематома, необхідно розпочати невідкладні діагностичні та лікувальні заходи, в тому числі втручання з декомпресії спинного мозку.
Якщо передопераційне лікування НМГ є необхідним (пацієнти, які довгий час прикуті до ліжка, травма) і якщо користь від місцевої/регіональної спінальної анестезії була ретельно зважена, пацієнтам, які отримали перед операцією ін’єкції НМГ, можна проводити таку анестезію, за умови, що між ін’єкцією гепарину і спінальною анестезією пройшло не менше 12 годин.
Рекомендується ретельний моніторинг неврологічного статусу пацієнта з огляду на ризик гематоми спинного мозку.
Майже у всіх пацієнтів профілактичне лікування НМГ можна розпочинати через 6-8 годин після анестезії або видалення катетера з контролем неврологічного статусу.
Особливо обережними слід бути при одночасному лікуванні іншими препаратами, які можуть впливати на систему гемостазу (зокрема нестероїдними протизапальними засобами, ацетилсаліциловою кислотою).
Стани, пов’язані з особливим ризиком (слід посилити спостереження за ходом лікування):
- печінкова недостатність;
- шлунково-кишкові виразки або інші органічні ураження зі схильністю до кровотечі в анамнезі;
- судинні захворювання сітківки ока;
- післяопераційний період після хірургічного втручання на головному або спинному мозку;
- люмбальна/спинномозкова пункція: слід враховувати ризик інтраспінальної кровотечі і по можливості − відкладати її проведення на якнайдовший час;
- одночасне застосування з лікарськими засобами, що впливають на гемостаз (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Процедура черезшкірної реваскуляризації при коронарній ангіопластиці. Для мінімізації ризику виникнення кровотечі під час коронарної ангіопластики з приводу нестабільної стенокардії, інфаркту міокарда без зубця Q та гострого інфаркту міокарда з підйомом сегмента ST рекомендується строго дотримуватись рекомендованих інтервалів між ін’єкціями еноксапарину. Після коронарної ангіопластики необхідно провести гемостаз на місці судинної пункції. Якщо використовується оклюзійний пристрій, інтродьюсер можна видаляти відразу. Якщо застосовується мануальна компресія, інтродьюсер видаляється через 6 годин після останньої підшкірної/внутрішньовенної ін’єкції еноксапарину. При продовженні лікування еноксапарином наступну ін’єкцію слід вводити не раніше ніж через 6-8 годин після видалення інтродьюсера. Слід вести нагляд за місцем пункції для виявлення ознак кровотечі або гематоми.
Застосування у період вагітності або годування груддю.
Вагітність. Дослідження на тваринах не дали доказів наявності в еноксапарину тератогенної дії. При відсутності у тварин тератогенного ефекту тератогенний вплив на людину не очікується. На сьогодні в ході правильно виконаних досліджень на двох біологічних видах тварин було доведено, що речовини, які спричиняють вади розвитку у людини, є тератогенними для тварин.
Профілактичне застосування у І триместрі вагітності та лікування. Клінічні дані, що наявні на цей час, є недостатніми для визначення можливого тератогенного або фетотоксичного ефекту еноксапарину при призначенні його з профілактичною метою у І триместрі вагітності та в лікувальних дозах протягом усього періоду вагітності. Тому небажано застосовувати еноксапарин для профілактики у І триместрі вагітності та в лікувальних дозах протягом усієї вагітності.
Якщо планується застосування епідуральної анестезії, профілактичне лікування еноксапарином слід припинити, якщо це можливо, за 12 годин до анестезії.
Епідуральну або спінальну анестезію ніколи не слід проводити під час лікування НМГ.
Профілактичне застосування у ІІ та ІІІ триместрах вагітності. На сьогодні обмежена кількість випадків клінічного застосування еноксапарину в ІІ та ІІІ триместрах вагітності не свідчать про наявність тератогенного або фетотоксичного ефектів при призначенні препарату в профілактичних дозах. Проте необхідно провести додаткові клінічні дослідження наслідків впливу препарату при таких станах. У зв’язку з цим профілактичне застосування еноксапарину слід розглядати лише за необхідності.
Якщо планується застосування епідуральної анестезії, профілактичне застосування гепарину слід перервати не пізніше ніж за 12 годин до застосування анестезії.
Годування груддю. Оскільки абсорбція препарату у шлунково-кишковому тракті новонароджених маловірогідна, жінкам, які годують груддю, лікування гепарином не протипоказане.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами. Прийом препарату не впливає на здатність керувати автотранспортним засобом або іншими механізмами. Проте, слід бути обережними з огляду на можливі побічні реакції (див. розділ «Побічні реакції»).
Спосіб застосування та дози.
Для підшкірного введення (за винятком хворих, які перебувають на гемодіалізі, а також хворих із гострим інфарктом міокарда з підйомом сегмента ST, які потребують болюсного введення).
Ця форма випуску призначена для дорослих.
Засіб не призначений для внутрішньом'язового введення.
1 мл розчину еквівалентний приблизно 10000 анти-Ха МО еноксапарину.
Техніка підшкірного введення. За допомогою градуйованого шприца та голки, призначеної для підшкірних ін’єкцій, відібрати з флакона точну кількість, яка необхідна для ін’єкції. У разі багатодозових флаконів рекомендується використовувати дуже тонкі голки (з максимальним діаметром 0,5 мм).
Еноксапарин слід вводити у вигляді ін’єкції у підшкірну тканину, бажано у положенні хворого лежачи на спині. Ін’єкції вводяться в передньолатеральну та задньолатеральну стінку живота, поперемінно в праву та ліву.
Голку необхідно вводити перпендикулярно, а не під кутом, на всю її довжину у затиснену складку шкіри, яку тримають між великим і вказівним пальцем до кінця введення розчину.
Техніка внутрішньовенного (болюсного) введення препарату із використанням багатодозового флакона, КЛЕКСАН® 300, для лікування гострого інфаркту міокарда з підйомом сегмента ST. Лікування починають із внутрішньовенної болюсної ін’єкції, після якої відразу роблять підшкірну ін'єкцію. Багатодозовий флакон слід використовувати, коли необхідно взяти початкову дозу, яка дорівнює 3000 МО, тобто 0,3 мл, за допомогою градуйованого 1 мл інсулінового шприца.
Цю дозу вводять у трубку внутрішньовенної крапельниці. Не допускається змішування препарат Клексан® 300 або одночасне введення з іншими лікарськими засобами. Для видалення залишків інших лікарських засобів і, отже, попередження їх змішування з еноксапарином перед та після внутрішньовенного болюсного введення еноксапарину крапельницю необхідно промити достатньою кількістю стандартного фізіологічного розчину або розчину глюкози. Еноксапарин безпечно вводити з 0,9 % стандартним фізіологічним розчином або 5 % розчином глюкози.
В умовах стаціонару багатодозовий флакон можна використовувати, якщо необхідно:
- отримати дозу 100 МО/кг, необхідну для першої підшкірної ін'єкції, яку вводять одночасно з внутрішньовенним болюсом, а також повторну дозу 100 МО/кг, необхідну для підшкірного введення кожні 12 годин;
- отримати дозу 30 МО/кг для внутрішньовенного болюсного введення для хворих яким буде застосовано коронарну ангіопластику.
Загальні рекомендації. Під час усього періоду лікування необхідно регулярно контролювати рівень тромбоцитів у зв'язку з ризиком гепариніндукованої тромбоцитопенії (ГІТ) (див. розділ «Особливості застосування»).
Профілактика венозної тромбоемболії при хірургічних втручаннях помірного або високого ризику. Ці рекомендації звичайно стосуються хірургічних процедур, що проводяться під загальною анестезією. У разі застосування спінальної та епідуральної анестезії необхідно зважити користь передопераційної ін'єкції еноксапарину відносно теоретично високого ризику спінальної гематоми (див. розділ «Особливості застосування»).
Застосовують один раз на добу.
Дозування. Дозу потрібно визначати за індивідуальним ризиком, що стосується окремого хворого та типу хірургічного втручання.
Хірургічні операції, пов’язані з помірним ризиком утворення тромбів. У разі проведення операцій, пов’язаних з помірним ризиком утворення тромбів, а також хворим, які не належать до групи високого ризику розвитку тромбоемболії, для ефективної профілактики достатньо введення 2000 анти-Ха МО (0,2 мл) один раз на добу. За цією схемою першу дозу вводять за 2 години до початку операції.
Хірургічні операції, пов'язані з високим ризиком утворення тромбів.
Операції на тазостегновому та колінному суглобі. Доза становить 4000 анти-Ха (0,4 мл) та вводиться один раз на добу. За цією схемою перша доза становить 4000 анти-Ха (повна доза) і вводиться за 12 годин до початку операції або перша доза становить 2000 анти-Ха (половина дози) та вводиться за 2 години до початку операції.
Інші випадки. При наявності підвищеного ризику розвитку венозної тромбоемболії, зумовленого типом хірургічного втручання (зокрема онкологічна хірургія) та/або станом хворого (зокрема венозна тромбоемболія в анамнезі), можна розглянути можливість введення профілактичної дози, що ідентична тій, яка застосовується в ортопедичній хірургії у разі операцій, пов’язаних з високим ризиком, таких як операції на тазостегновому та колінному суглобі.
Тривалість лікування. Лікування НМГ слід проводити разом із застосуванням стандартних методів використання еластичного бандажу для ніг до повного переведення хворого на амбулаторне лікування:
- у загальній хірургії тривалість лікування НМГ повинна становити не менше 10 днів, якщо для цього хворого не існує специфічного ризику розвитку тромбоемболії вен (див. розділ «Особливості застосування»);
- було доведено терапевтичну користь профілактичного лікуванням із застосуванням дози еноксапарину 4000 анти-Ха МО на добу після операції на тазостегновому суглобі протягом 4-5 тижнів;
- якщо після рекомендованого курсу лікування у хворого зберігається ризик венозної тромбоемболії, слід розглянути можливість застосування пероральних антикоагулянтів для подальшої профілактичної терапії; проте клінічна користь тривалого лікування низькомолекулярними гепаринами або пероральними антикоагулянтами поки що не вивчалась.
Попередження згортання крові в екстракорпоральній системі кровообігу під час процедури гемодіалізу (зазвичай при її тривалості 4 години або менше).
Внутрішньосудинне введення (в артеріальній гілці діалізної системи). У хворих, яким проводять повторні сеанси гемодіалізу, профілактика згортання крові в екстраренальній очисній системі досягається шляхом введення початкової дози, що дорівнює 100 анти-Ха МО/кг, в артеріальну гілку діалізної системи на початку сеансу.
Ця доза, що вводиться у вигляді одноразової внутрішньосудинної болюсної ін'єкції, може застосовуватись тільки для сеансів гемодіалізу тривалістю 4 години або менше. Згодом вона може корегуватися з огляду на індивідуальну та міжгрупову мінливість.
Максимальна рекомендована доза - 100 анти-Ха МО/кг.
Хворим, які перебувають на гемодіалізі і мають високий ризик кровотечі (зокрема при передопераційному та післяопераційному діалізі) або у яких активна кровотеча, сеанси діалізу можна проводити, застосовуючи дозу 50 анти-Ха МО/кг (два введення в судину) або 75 анти-Ха МО/кг (одне введення в судину).
Лікування діагностованого тромбозу глибоких вен, що супроводжується легеневою тромбоемболією або без неї та не має тяжких клінічних симптомів, за винятком легеневої тромбоемболії, яка вимагає лікування тромболітичним засобом або хірургічного втручання. При будь-якій підозрі на тромбоз глибоких вен слід швидко підтвердити діагноз, провівши відповідне обстеження.
Вводять: дві ін’єкції на добу з інтервалом у 12 годин.
Дозування. Доза для однієї ін’єкції становить 100 анти-Ха МО/кг. Дозування НМГ для хворих з масою тіла більше 100 кг або менше 40 кг не вивчалось. У хворих з масою тіла більше 100 кг ефективність терапії НМГ може бути дещо нижчою, а у хворих з масою тіла менше 40 кг може бути підвищеним ризик кровотечі. Такі хворі повинні знаходитись під окремим клінічним спостереженням.
Тривалість лікування тромбозу глибоких вен (ТГВ). Лікування низькомолекулярним гепарином слід якомога швидше замінити терапією пероральними антикоагулятивними засобами, якщо вона не протипоказана. Тривалість лікування НМГ не повинна перевищувати 10 днів, враховуючи час, необхідний для отримання відповідного ефекту перорального антикоагулянта, виключаючи такі випадки, коли цей ефект важко досягти (див. розділ «Особливості застосування»). Отже, лікування пероральними антикоагулянтами слід розпочинати якомога раніше.
Лікування нестабільної стенокардії та гострого інфаркту міокарда без зубця Q, у комбінації з ацетилсаліциловою кислотою. Еноксапарин призначають у дозі 100 анти-Ха МО/кг підшкірно два рази на добу через кожні 12 годин у комбінації з аспірином (рекомендована доза − 75-325 мг внутрішньо після мінімальної навантажувальної дози 160 мг). Рекомендована тривалість лікування становить 2-8 днів до досягнення хворим стабільного клінічного стану.
Лікування гострого інфаркту міокарда з підйомом сегмента ST, у комбінації з тромболітичним засобом у хворих для яких можливе подальше застосування коронарної ангіопластики, а також без неї. Після початкової внутрішньовенної болюсної ін’єкції 3000 анти-Ха МО вводять підшкірно 100 анти-Ха МО/кг протягом наступних 15 хв, потім кожні 12 годин (для перших двох підшкірних введень максимум 10000 анти-Ха МО). Першу дозу еноксапарину слід вводити за 15 хв до або через 30 хв після початку тромболітичної терапії (фібриноспецифічної або ні).
Рекомендована тривалість лікування становить 8 днів або до виписки хворого зі стаціонару, якщо період госпіталізації становить менше 8 днів.
Супутня терапія: прийом аспірину слід починати якнайшвидше після появи симптомів і продовжувати з дозуванням 75-325 мг на добу протягом не менше 30 днів, якщо не показане інше.
Хворі, яким застосовано коронарну ангіопластику:
- якщо з часу останнього підшкірного введення еноксапарину до накачування балона пройшло менше 8 годин, додаткове введення еноксапарину не потрібне;
- якщо з часу останнього підшкірного введення еноксапарину до накачування балона пройшло більше 8 годин, необхідно ввести внутрішньовенну болюсну ін’єкцію 30 анти-Ха МО/кг еноксапарину. Для забезпечення точності об’ємів для введення рекомендується розвести препарат до 300 МО/мл (тобто 0,3 мл еноксапарину, розведеного у 10 мл) (див. таблицю нижче).
Об’єми для введення, коли розведення здійснюється для хворих з коронарною ангіопластикою:
| Маса тіла | Необхідна доза | Об`єм для введення при розведенні до 300 МО/мл (тобто 0,3 мл еноксапарину, розведені в 10 мл) |
| кг | МО | мл |
| 45 | 1350 | 4,5 |
| 50 | 1500 | 5 |
| 55 | 1650 | 5,5 |
| 60 | 1800 | 6 |
| 65 | 1950 | 6,5 |
| 70 | 2100 | 7 |
| 75 | 2250 | 7,5 |
| 80 | 2400 | 8 |
| 85 | 2550 | 8,5 |
| 90 | 2700 | 9 |
| 95 | 2850 | 9,5 |
| 100 | 3000 | 10 |
Пацієнти віком від 75 років. Початкову внутрішньовенну болюсну ін’єкцію не вводять хворим віком 75 років і старшим, які знаходяться на лікуванні з приводу гострого інфаркту міокарда з підйомом сегмента ST. Їм слід вводити підшкірно 75 анти-Ха МО/кг кожні 12 годин (максимум 7500 анти-Ха МО тільки для перших двох ін’єкцій).
Діти. Через відсутність відповідних даних не рекомендується застосовувати НМГ дітям. Застосування дітям віком до 3 років протипоказано через вміст бензилового спирту. Таким хворим слід призначати нефракціонований гепарин. У недоношених немовлят під час введення лікарських засобів, що містять бензиловий спирт, спостерігалося таке порушення дихання, як синдром утрудненого дихання (метаболічний ацидоз, неврологічні розлади, паузи в диханні та ін.)
Передозування.
Випадкове передозування при підшкірному введенні великих доз низькомолекулярного гепарину може призвести до геморагічних ускладнень.
У разі кровотечі для лікування деяких хворих можна застосовувати протаміну сульфат, враховуючи такі фактори:
- ефективність протаміну набагато нижча, ніж ефективність, зареєстрована при передозуваннях нефракціонованого гепарину;
- через побічні реакції (зокрема анафілактичний шок) слід ретельно зважити співвідношення ризик/користь для протаміну сульфату. Нейтралізацію еноксапарину здійснюють за допомогою повільного внутрішньовенного введення протаміну (сульфату або гідрохлориду).
Необхідна доза протаміну залежить:
- від введеної дози гепарину (100 протигепаринових одиниць протаміну нейтралізують активність 100 анти-Ха МО низькомолекулярного гепарину), якщо з моменту введення еноксапарину натрію пройшло не більше 8 годин;
- від часу, що пройшов з моменту введення гепарину:
- можливе введення інфузії 50 протигепаринових одиниць протаміну на 100 анти-Ха МО еноксапарину натрію, якщо з моменту введення еноксапарину натрію пройшло більше 8 годин або якщо буде потреба в другій дозі протаміну;
- якщо з моменту ін’єкції еноксапарину натрію пройшло більше 12 годин, немає необхідності вводити протамін.
Ці рекомендації стосуються хворих з нормальною нирковою функцією, які отримують повторні дози.
Однак неможливо повністю нейтралізувати анти-Ха активність еноксапарину. Більше того, нейтралізація може мати тимчасовий характер через особливість абсорбції низькомолекулярного гепарину, і в результаті може виникнути необхідність розподілити загальну розраховану дозу протаміну на декілька ін’єкцій (2-4) для введення протягом 24 годин.
Після потрапляння низькомолекулярного гепарину до шлунка тяжкі ускладнення маловірогідні навіть при великих кількостях (таких випадків зареєстровано не було) через незначне шлункове та кишкове всмоктування лікарського засобу.
Побічні реакції.
Були зареєстровані випадки значних геморагічних ускладнень, деякі з них були летальними. Нечастими побічними реакціями були внутрішньочерепні та ретроперитонеальні крововиливи. Також реєструвалися випадки геморагічних ускладнень (кровотечі), таких як гематома, екхімоз у місцях, відмінних від місця ін’єкції, гематома рани, гематурія, носова кровотеча та шлунково-кишкова кровотеча.
Геморагічні симптоми переважно пов’язані із:
- присутністю асоційованих факторів ризику, таких як органічні ураження зі схильністю до виникнення кровотеч, а також застосування деяких комбінацій лікарських засобів (див. розділи «Протипоказання» та «Взаємодії з іншими лікарськими засобами та інші форми взаємодії»), літній вік, ниркова недостатність, низька маса тіла;
- недотриманням терапевтичних рекомендацій, зокрема стосовно тривалості лікування та корекції дози з урахуванням маси тіла пацієнта (див. розділ «Особливості застосування»).
Повідомлялося про рідкісні випадки виникнення гематоми спинного мозку після застосування низькомолекулярного гепарину під час спінальної анестезії, аналгезії або епідуральної анестезії. Ці реакції призводили до неврологічних розладів різного ступеня тяжкості, в тому числі до тривалого або необоротного паралічу (див. розділ «Особливості застосування»).
Підшкірне введення препарату може призвести до утворення гематом у місці ін’єкції. Були зареєстровані випадки болю у місці ін’єкції, інших реакцій, включаючи подразнення, набряк у місці ін’єкції, гіперчутливість, запалення та утворення вузликів. Цей ризик зростає, якщо порушується рекомендована методика виконання ін’єкції або використовуються невідповідні ін’єкційні матеріали для її проведення. Запальні вузлики у місці ін’єкції, які минають через кілька днів, можуть виникати внаслідок запальної реакції і не вимагають відміни препарату.
Повідомлялося про виникнення тромбоцитопенії. Існує два види тромбоцитопенії:
- тип І, що спостерігається у більшості випадків, зазвичай середньої тяжкості (> 100 000/мм3), виникає на ранніх етапах (до 5 дня лікування) та не потребує відміни препарату;
- тип ІІ є рідкісною серйозною імуноалергічною тромбоцитопенією (ГІТ) з тромбозом; у деяких випадках тромбоз був ускладнений інфарктами органів або ішемією кінцівок. Її поширеність залишається недостатньо вивченою (див. розділи «Особливості застосування»).
Можливе безсимптомне та оборотне підвищення вмісту тромбоцитів.
Повідомлялося про випадки виникнення геморагічної анемії.
На тлі застосування гепаринів були зареєстровані рідкісні випадки некрозу шкіри, які у більшості випадків спостерігалися у місці проведення ін’єкції. Появі цих явищ може передувати виникнення пурпури або інфільтрованих та болісних еритематозних бляшок. У таких випадках слід негайно відмінити препарат.
Спостерігалися рідкісні випадки шкірних (кропив’янка, свербіж, еритема, бульозні висипання) або системних алергічних проявів (анафілактичні/анафілактоїдні реакції, включаючи шок), які іноді призводили до відміни препарату.
Як і при застосуванні нефракціонованих гепаринів, при тривалому лікуванні цим препаратом не можна виключати ризик розвитку остеопорозу.
Нефракціоновані гепарини можуть спричиняти гіпоальдостеронізм, який призводить до збільшення плазмових рівнів калію. Рідко може виникнути клінічно значуща гіперкаліємія, особливо у пацієнтів із хронічною нирковою недостатністю та цукровим діабетом.
Повідомлялося про випадки транзиторного підвищення рівнів трансаміназ, гепатоцелюлярного або холестатичного ураження печінки.
Повідомлялося про декілька випадків виникнення гіперкаліємії.
Повідомлялося про виникнення головного болю, алопеції.
Дуже рідко спостерігався васкуліт, обумовлений гіперчутливістю шкіри.
Дуже рідко спостерігалася гіпереозинофілія, окремо або разом із шкірними реакціями, що призводила до відміни препарату.
Термін придатності. 2 роки.
Термін придатності після відкриття флакона – не більше 28 днів.
Умови зберігання. Зберігати у недоступному для дітей місці. Зберігати в оригінальній упаковці при температурі не вище 25 °C. Не заморожувати.
Упаковка. № 1: по 1 багатодозовому флакону по 3 мл в картонній коробці.
Категорія відпуску. За рецептом.
Виробник.
ФАМАР ХЕЛС КЕАР СЕРВІСІЗ МАДРИД, С.А.У., Іспанія.
Місцезнаходження виробника та адреса місця провадження його діяльності.
Авеніда Леганес, 62, Алькоркон 28923 Мадрид, Іспанія.
Заявник.
ТОВ «Санофі-Авентіс Україна», Україна.
ЭНОКСАПАРИН НАТРИЙ
Нажмите на одно или несколько действующих веществ для поиска аналогов по составу.
Аналоги - препараты, имеющие то же международное непатентованое наименование.
В аптеке бывают лекарства-аналоги.
Альго-Фарм поможем Вам ознакомится с информацией и подобрать лекарства, если препарат проходит перерегистрацию или снят с производства.
Дорогостоящий препарат иногда можно заменить более дешевым аналогом.
Для замены препарата на аналог обязательно проконсультируйтесь с врачем или провизором.
Можно найти, отсортировать препараты низких цен. Могут отличаться дозы действующих веществ.
Отзывы аптеки
Список отзывов пуст
Добавить отзыв
Черкассы, Днепр, Винница, Ровно, Чернигов, Львов